Выдержки:
Микроклональное размножение плодовых и ягодных культур как основа ведения современного прибыльного садоводства.
Представлены теоретические и практические аспекты ведения современного прибыльного садоводства, базируясь на использовании безвирусного посадочного материала полученного путём микроклонального размножения.
В настоящее время в отечественных садоводческих производственных кругах ведётся дискуссия относительно целесообразности использования безвирусного (сертифицированного) посадочного материала полученного путём микроклонального размножения in vitro в связи с его высокой стоимостью.
Иной причиной, которая нивелируют целесообразность применение такого посадочного материала, являются неоднократные случаи пресечения карантинными службами попыток ввоза на территорию Российской Федерации и Украины импортного посадочного материала зараженного карантинными объектами. Также обнаружены уже существующие очаги таких объектов в промышленных насаждениях и ведётся работа по их локализации и устранению [1, 2]. Вследствие этого садоводческие предприятия несут большие убытки, от чего к такому посадочному материалу складывается недоверие. Необходимо отметить, что не все питомники Европейского Союза (в основном из них импортируется посадочный материал) работают с безвирусными растениями, полученными in vitro в качестве базисного материала, и не все ведут ответственный бизнес.
Внутреннюю инфекцию в растениях часто трудно обнаружить или же вообще практически не возможно. Но при её наличии она всё равно проявляется и, как правило, уже на тех этапах роста и развития растений, когда нужно полностью выкорчёвывать молодой сад, неся колоссальные убытки и доказать на каком этапе инфекция попала в растения или же она там присутствовала с самого начала уже не возможно.
С другой стороны, производители как свежих плодов и ягод, так и посадочного материала, которые имели возможность работать с безвирусным материалом, почти все склонны к тому, что при умеренной стоимости, его применение есть
более экономически выгодным, по сравнению с рядовым посадочным материалом.
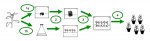
Для логической цепочки необходимо напомнить, что процесс микроклонального размножения растений in vitro требует прохождения следующих этапов:
- инициация культуры, или введение меристемной ткани растения на подходящую питательную среду;
- пролиферация, или наращивание микростеблей;
- укоренение микростеблей;
- акклиматизация и высадка в полевые условия (in vivo).
Наиболее целесообразно применять безвирусные растения для
закладки маточных насаждений, будь то ягодных, орехоплодных, или же семечковых и косточковых культур, а также подвоев к ним. Применяя его, таким образом, обязательным условием есть периодический контроль путём тестирования отсутствия патогенных организмов в маточных растениях (как правило, раз в два года), пространственная изоляция и агротехнический уход на высоком уровне. Хотя в садоводческих предприятиях, уже давно пришедших к выводу, что микроклональное размножение – путь к повышению продуктивности, урожайности и качеству плодов, есть целесообразность закладки товарных насаждений и таким, казалось бы, дорогостоящим посадочным материалом.
Экономически хорошо сбалансированный рынок производства продукции садоводства и умеренной стоимости посадочного материала, полученного данным способом в результате постановки его на промышленную коммерческую основу, даёт возможность масштабировать в соответствии со спросом, при сравнительно небольшой себестоимости по сравнению с выращиванием посадочного материала традиционными путями (первый есть более трудоёмкий). Поэтому закладка ягодников, первого поля питомника, или же насаждений фундука материалом непосредственно полученного in vitro часто практикуется.
Наиболее вредоносные вирусы способны приводить к потерям 20–70% урожая. По этому, анализ распространённости вирусных болезней, прогноз их развития, уничтожение очагов карантинных объектов и создание безвирусного питомниководства плодовых и ягодных культур являются актуальной задачей защиты растений .
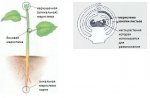
В России и Украине есть лаборатории почти при всех профилирующих научных и образовательных учреждениях, где изучаются вопросы, связанные с проблемами микроклонального размножения растений и их оздоровления. Для большинства плодовых и ягодных культур, а также в сортовом разрезе, подобраны оптимальные питательные среды для культивирования их in vitro на различных этапах размножения, а также отработаны методики тестирование растений на наличие латентных патогенов. Но всё-таки узким местом в цепочке от меристемы до готового саженца является
акклиматизация эксплантов in vivo (в условия внешней среды, вне пробирки). На данном этапе растения требуют определённых параметров микроклимата. Для возделывания посадочного материала в промышленных масштабах это делается в акклиматизационных комплексах оснащённых специальным оборудованием позволяющим регулировать параметры
микроклимата в зависимости от этапа акклиматизации растений и климатических условий внешней среды.
Как известно, приборы и оборудование для обустройства лаборатории микроклонального размножения растений, компоненты для приготовления питательных сред, обустройство акклиматизационных комплексов и оплата труда квалифицированного персонала требуют значительных капиталовложений. Поэтому, в странах, где микроклональное размножение плодовых и декоративных культур поставлено на коммерческую основу, этот очень необходимый сегмент садоводческой отрасли
обслуживается частными компаниями.
Причина преимущества применения безвирусного посадочного материала полученного in vitro кроется в том, что растения, проходя путь от меристемастических клеток до взрослых растений,
проходят процесс “реювенилизации” (омолаживания) в результате чего лишаются действия накопившейся в растениях
“усталости” вызванной стрессовыми факторами (особенно актуально, после 20-30 летнего возраста)
Поэтому, применяя оздоровленный посадочный материал в комплексе с высокой агротехникой, можно получить более высокую отдачу урожая и
более раннее вступление растений в период товарного плодоношения, таким образом обеспечить быстрое возвращение
вложенных инвестиций и получить более высокий доход по сравнению с использованием обычного посадочного материала.
С научно-производственной позиции к недостаткам микроклонального размножения относят иногда проявляющуюся генетическую нестабильность материала in vitro. То есть, проходя через in vitro условия, геном растительного материала способный поддаваться мутациям в результате действия разнообразных факторов, а в последнее время широкого применения ферментов, и на выходе может отличаться от материнских растений. Как показывает практика,
вероятность возникновения таких отклонений небольшая, и при выращивании в промышленных масштабах особого опасения не вызывает. К тому же, в процессе акклиматизации и
доработки посадочного материала до стандартных кондиций, он проходит тщательный визуальный контроль и при выявлении растений с явно выраженными отклонениями, они
выбраковываются. Базисные клоны, с которых берут экспланты для размножения in vitro во избежание возникновения генетических отклонений, наиболее целесообразно тестировать с помощью молекулярных маркеров.
Применяя безвирусный посадочный материал для закладки садов в комплексе с оптимальным научно обоснованным районированием культур и сортов, а также научно обоснованными схемами размещения растений в насаждениях, системами формирования и придерживаясь высокого уровня агротехники, можно добиться наивысшей урожайности плодовых, ягодных и орехоплодных культур.
Таким образом, безвирусный посадочный материал ягодных культур, полученный in vitro целесообразно применять как для закладки маточных, так и плодоносных насаждений. Вегетативные подвои для косточковых культур (вишня, черешня, абрикос, слива, алыча, персик, нектарин), полученные таким же образом, экономически обосновано применять
как для высадки в первое поле питомника, для непосредственного выращивания саженцев, так и для закладки маточных насаждений.
Насаждения фундука (лесного ореха) наиболее выгодно закладывать материалом, непосредственно полученным in vitro, так как при этом получается очень выровненные саженцы, которые отлично приживаются.
Касательно подвоев для семечковых культур (яблоня, груша, айва) экономически целесообразно сертифицированный посадочный материал применять для закладки маточников клоновых подвоев и возделывать по традиционным схемам. При этом растения необходимо тестировать на отсутствие латентных патогенов минимум один раз в два года, соблюдать пространственную изоляцию между насаждениями и применять высокого уровня агротехнику.
Маточно-черенковые сады необходимо закладывать саженцами, подвойная и привойная части которых были получены непосредственно in vitro и прошли тестирование на отсутствие патогенов, при этом также необходима пространственная изоляция и соответственный агротехнический уход, с периодическим тестированием на отсутствие патогенных организмов.
Как правило, насаждения будь то маточники ягодников, клоновых подвоев или же маточно-черенковые сады, которые были заложены безвирусным посадочным материалом, полученным in vitro в сертифицированных лабораториях, и за которыми ведётся уход в соответствии с необходимыми нормами и требованиями, паспортизируются, и ведётся их учёт государственными отраслевыми органами управления.
Это впоследствии служит основой для получения сертификата, что посадочный материал, полученный с их использованием, является безвирусным.
Поэтому, для ведения прибыльного садоводческого бизнеса, будь то возделывание свежих плодов или ягод, посадочного материала, или в комплексе, что является наиболее выгодным, необходимо применять сертифицированный безвирусный посадочный материал.
ОЛЕГ СЕРДЮК
к. с.-х. н., �Киев, Украина